Een ongekende uitdaging voor farmaceutische bedrijven begin vorig jaar: maak zo snel mogelijk een vaccin dat 8 miljard mensen op de wereld beschermt tegen het COVID-19-virus. Een sterk en uiterst geraffineerd virus. Iedereen kan het krijgen, niemand heeft de afgelopen jaren antistoffen opgebouwd. Het heeft bovendien een ander ziekteverloop dan de eerdere coronavirussen zoals MERS (Middle East Respiratory Syndrome) en SARS-CoV1 (Severe Acute Respiratory Syndrome) waaraan patiënten vaak snel overlijden. Anders dan bij MERS en SARS ontwikkelen niet alle dragers van het COVID-19-virus ernstige ziekteverschijnselen. Een groot voordeel, maar ook een nadeel: het virus kan zich daardoor razendsnel wereldwijd verspreiden.
Traditionele vaccinmakers blijven achter
Overal ter wereld gaan teams aan de slag om een vaccin te ontwikkelen. Pfizer-BioNTech brengt elf maanden na de eerste COVID-uitbraak als eerste een werkend vaccin op de markt. Moderna en AstraZeneca komen snel daarna. Andere farmaceuten werken nog aan een vaccin. In de normaliter competitieve sector is de concurrentie tussen de partijen met een vaccin beperkt. Geen van de partijen kan immers in zijn eentje het benodigde aantal vaccins voor de hele wereldbevolking leveren. Wetenschappers en farmabedrijven houden zich al eeuwen bezig met de ontwikkeling van vaccins, het eerste vaccin – tegen de pokken – werd in 1796 ontdekt. Opvallend: de bedrijven die nu naar de markt komen met een COVID-19-vaccin laten de traditionele makers van vaccins dankzij innovatieve technologie achter zich. Eén van de belangrijkste hedendaagse vaccinmakers Merck – producent van vaccins tegen baarmoederhalskanker en ebola – besloot eind januari zelfs te stoppen met de ontwikkeling van een COVID-vaccin na tegenvallende resultaten.
Specialisatie
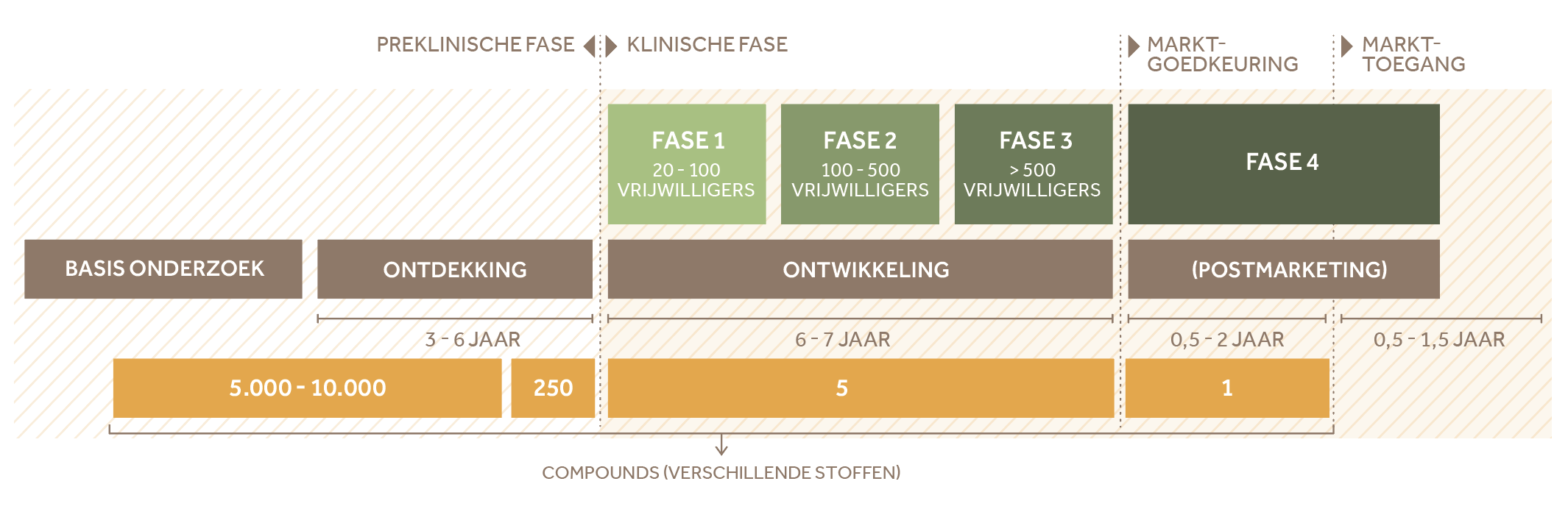
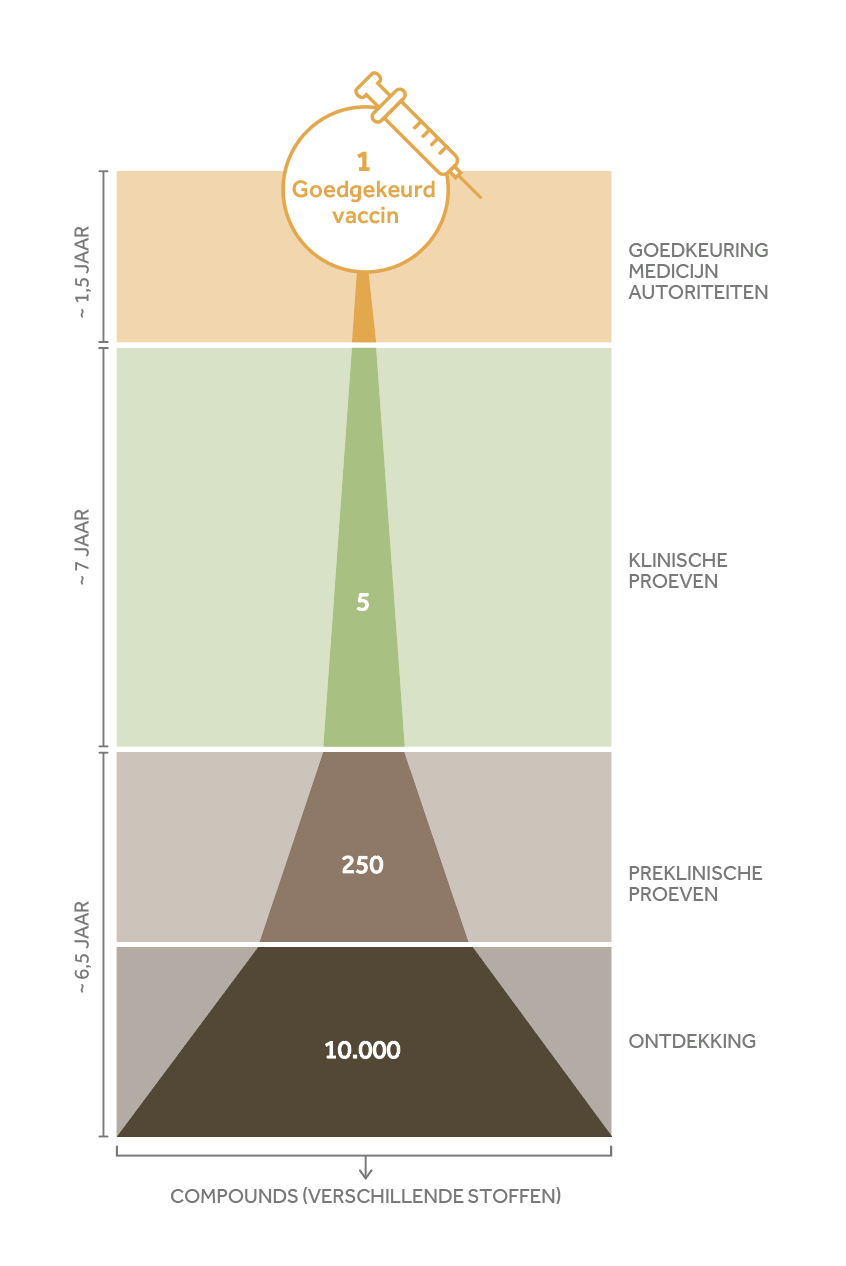
De nu beschikbare vaccins komen ook van farmabedrijven die zich daarvoor niet met dit vakgebied bezighielden. Zo is het Duitse biotechbedrijf BioNTech gespecialiseerd in immunotherapie voor kankerpatiënten. Het bedrijf werkt bij de productie van het vaccin nauw samen met Amerikaanse farmagigant Pfizer, dat de test-infrastructuur en distributie van de vaccins regelt. Door de biotechonderzoekmethodes en de samenwerking met een grote farmaproducent kon de traditionele manier van ontwikkeling, die normaliter vijf jaar duurt, teruggebracht worden tot minder dan een jaar. Zo’n uitstap naar de vaccinproductie is ongebruikelijk binnen de van oudsher sterk gespecialiseerde farmasector. De farmaproducenten focussen vaak ieder op een andere aandoening, omdat de markt voor nieuwe medicijnen relatief klein is. Ook omdat een nieuw geneesmiddel aantoonbaar betere resultaten moet laten zien dan een bestaand geneesmiddel om door de toezichthouder te worden toegelaten op de markt. Bovendien worden niet alle nieuwe medicijnen door ziektekostenverzekeraars vergoed. Alleen patiënten bij wie het bestaande medicijn onvoldoende werkt, komen voor een nieuw medicijn in aanmerking. De meeste patiënten blijven het bestaande medicijn ontvangen. Van deze medicijnen verloopt op termijn het patent. Dat maakt de weg vrij voor de concurrentie; waardoor de prijs van het medicijn daalt.
Genetisch materiaal van een virus
Juist innovatieve technologie zorgt dus voor de snelle vaccindoorbraak. Traditioneel wordt bij vaccinatie het virus of een onderdeel daarvan in verzwakte vorm ingespoten. Het vaccin zet dan het lichaam aan tot het maken van antistoffen. AstraZeneca en Janssen slaagden erin de traditionele wijze van vaccinontwikkeling te verbeteren door het genetische materiaal van het COVID-19-virus te onderscheiden. Niet het virus zelf wordt ingespoten, maar er wordt genetisch materiaal van het nieuwe COVID-19-virus in de celkern gebracht. Een omhulsel zorgt ervoor dat het virusdeeltje op de juiste plek komt, AstraZeneca gebruikt hiervoor een inactief gemaakt verkoudheidsvirus. Eenmaal in de celkern prikkelt het virusmateriaal het lichaam om zelf het viruseiwit te produceren en lokt daarmee een immuunreactie uit. Deze behandelmethode werd al eerder gebruikt als gentherapie om onder andere een erfelijke oogziekte te genezen. Als vaccin was het nog niet eerder gebruikt.
DNA als boodschapper
De vaccinontwikkeling bracht ook de ontwikkeling van een meer experimentele biotechnologie toepassing in een stroomversnelling, die van het messenger-RNA. Messenger-RNA ofwel mRNA is het transportsysteem van de informatie die in het DNA is vastgelegd. Het mRNA bevat onder andere instructies voor de aanmaak van een eiwit. Door dit genetische materiaal van het virus gericht in te brengen op het juiste deel van ons DNA krijgen onze cellen de opdracht om eiwitten aan te maken die gelijk zijn aan die van delen van het virus. Ons lichaam wordt van binnenuit versterkt; de lichaamsvreemde eiwitten die het lichaam na vaccinatie zelf aanmaakt activeren het immuunsysteem. De vaccins van Moderna en BioNTech-Pfizer gaan uit van dit principe.
Dergelijke genetische vaccins werken goed en bieden tot wel 96% bescherming. Ter vergelijking: de griepprik geeft circa 40% bescherming. De genetische vaccins zijn relatief simpel te maken, maar zijn kwetsbaar: bij hoge temperaturen vallen het materiaal en de drager sneller uit elkaar dan een traditioneel vaccin. Dat zorgt voor nieuwe uitdagingen in de sector, omdat de distributie veel bewerkelijker is. Ieder vaccin heeft zijn eigen gebruiksaanwijzing. Zo kan het Moderna-vaccin in een reguliere vriezer en moet het Pfizer-BioNTech-vaccin bij 80 graden onder nul worden bewaard.
Big data is cruciaal
Big data, de computerrekenkracht om grote hoeveelheden data snel te verwerken, was cruciaal bij het ontwikkelen van vaccins. Om mRNA-technologie in te zetten, moet namelijk eerst de genetische code van het virus bekend zijn. Ook moest worden ontdekt hoe het virus er in slaagt de menselijke cellen binnen te dringen. Dat dat proces verloopt via eiwitten in onze cellen is bekend, maar welke delen van ons DNA en mRNA daarbij betrokken zijn bij een specifiek virus als COVID-19 is een ingewikkelde puzzel. Tot nu toe was intensief onderzoek bij patiënten nodig. Geavanceerde computers konden op basis van celmateriaal van de eerste patiënten met COVID-19 snel het dna-profiel van het virus bepalen. Het uit 30.474 bouwstenen – de nucleotiden – bestaande profiel kon dankzij algoritmen verder worden uitgeplozen. Ontdekt werd met welke van deze bouwstenen het virus erin slaagt de menselijke cel binnen te dringen om zich daar te vermenigvuldigen. De resultaten maken ook de weg vrij voor nog veel meer onderzoek op deze wijze. Bijvoorbeeld naar mutaties van het virus, nu en in de toekomst.
Maatschappelijke rol
De ontwikkeling van het vaccin geeft de farmasector een impuls. Nieuwe technologieën krijgen ruim baan en meer financiële middelen van investeerders. De bestaande weerstand tegen deze vorm van computerbiologie bij sommige klassiek geschoolde wetenschappers neemt af. Bovendien is er positieve aandacht voor de maatschappelijke rol van de sector. Die stond de afgelopen jaren onder druk door het bekend worden van onethische verkooppraktijken en testen in ontwikkelingslanden waar sommige farmaceuten zich schuldig aan maakten. Ook kwam de sector negatief in het nieuws door de forse prijsstijgingen van sommige levensreddende medicijnen. De vaccinmakers hebben de kritiek op de sector en hun maatschappelijke rol ongetwijfeld meegenomen bij het bepalen van de prijzen. Met prijzen tussen 4 en 20 euro per vaccinatie zijn de producten redelijk geprijsd en is vaccinatie voor iedereen bereikbaar. De relatief lage prijsstelling is bovendien mogelijk doordat veel overheden de ontwikkelkosten voor hun rekening hebben genomen.
Nieuwe uitdagingen
Voor de sector liggen er na de uitrol van de vaccinatie nog genoeg nieuwe uitdagingen. Het virus blijkt zich relatief makkelijk aan te kunnen passen in het menselijk lichaam. De mutaties van het virus die zo ontstaan, vragen net als bij een gewoon griepvirus om meer onderzoek en mogelijk andere vaccins. Daarnaast ontwikkelen veel mensen die zijn hersteld van het COVID-19-virus chronische klachten aan onder andere de longen. Dat vraagt om nieuwe medicijnen en behandelingen.